Ascendis Pharma(本社:デンマーク、コペンハーゲン)は、プロドラッグ(※)と持続放出技術の利点を組み合わせた革新的なTransConの技術を応用して、アンメットメディカルニーズに向かい合うパイプラインを開発しています。 TransConの技術をタンパク質、ペプチドおよび小分子を含む既存の薬物療法に適用して、親薬物を変性させることなく予測可能かつ持続的に浸透させることのできるプロドラッグを生成することができます。
※投与されると生体による代謝作用を受けて活性代謝物へ変化し、薬効を示す医薬品
同社の新薬では、3つの内分泌系の希少疾患に焦点を当てられています。内1つを軟骨無形成症を対象として、現在、既存治療薬として焦点が当たるCNPに着目し患者の日々の負担を軽減すべく週次での投与を目指しています。
この小児の軟骨無形成症の治療薬において、同社は、2018年11月28日に「TransCon CNP」の第1相治験の終了を発表しました。また、2019年1月の投資家向け説明資料では、第2相治験を第3四半期(7-9月期)に開始することを目指すとされています。
若年健常サルの成長試験では、日々のCNPアナログ投与よりも効果が高く、また、週1回の投与としてデザインされた第一相治験では、良好な容認性が確認されています。
Ascendis Pharma(HQ: Copenhagen, Denmark) is applying its innovative TransCon technology, which combines the benefits of prodrug and sustained-release technologies, to develop a pipeline of therapeutics that address significant unmet medical needs. The TransCon technology can be applied to existing drug therapies, including proteins, peptides and small molecules, to create prodrugs that provide for the predictable and sustained release of an unmodified parent drug.
Now they are focusing on three rare disease endocrinology candidates, and one of the them is achondroplasia and they focus on CNP and they are trying to weekly dose treatment to decrease patients’ daily burden.
Regarding this treatment for children with achondroplasia, they released finishing TransCon CNP phase1 trial in 28th November 2018 and now seeking start Phase 3 according to their presentation slides.
Source:
TransConCNP :軟骨無形成症への週1回のCNP投与

バランスのよい成長は、バランスのよい刺激伝達経路が必要
TransCon CNPは、成長に必要な刺激伝達経路を最適化するために継続的にCNPが作用するように設計され、良好な耐容性があり患者負担の少ない週次投与で有効性を示します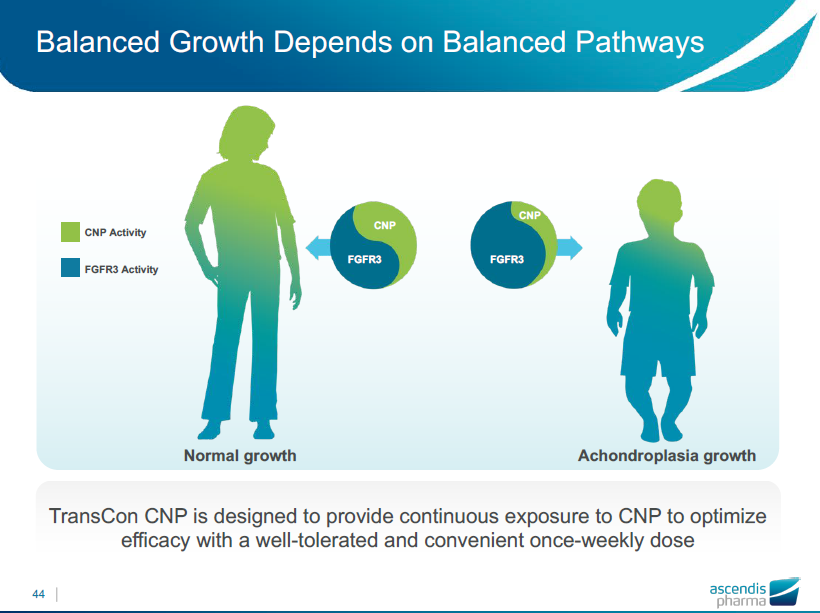
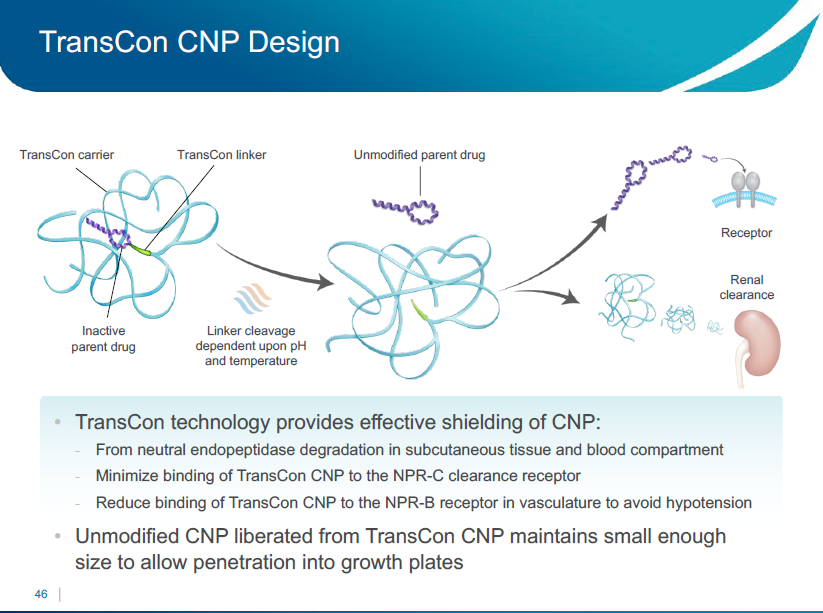
TransCon CNPのデザイン
TransConの応用科学では、効果的にCNPを保護することがわかってきました。
- 皮下組織および血液中の中性エンドペプチダーゼを分解
- TransCon CNPとNPR-Cクリアランス受容体との結合を最小限に抑える
- 低血圧を回避するために血管系のNPR-B受容体へのTransCon CNPの結合を低下
TransConから解放された未修飾CNPは、成長板への浸透を可能にする小さなサイズを十分に維持します。
若年健常サルの成長試験
用量に比例した脛骨の線形成長を示したことで、尺骨成長に一貫性が確認できました。
•未処理の対照と比較し、TransCon CNP最大投与量(100μg/kg)で70%以上増加したのに対し、高投与量CNPアナログ(140μg/kg/week・20μg/kg/day)で35%増加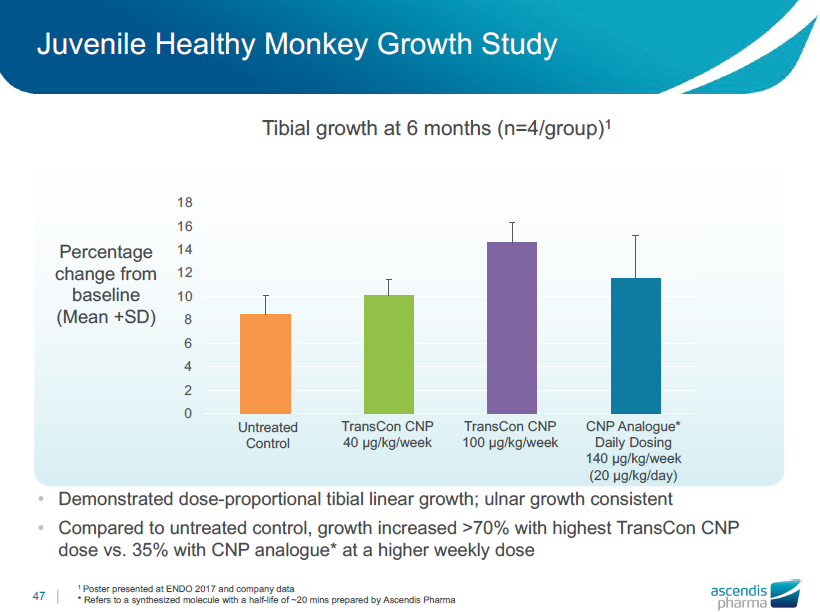
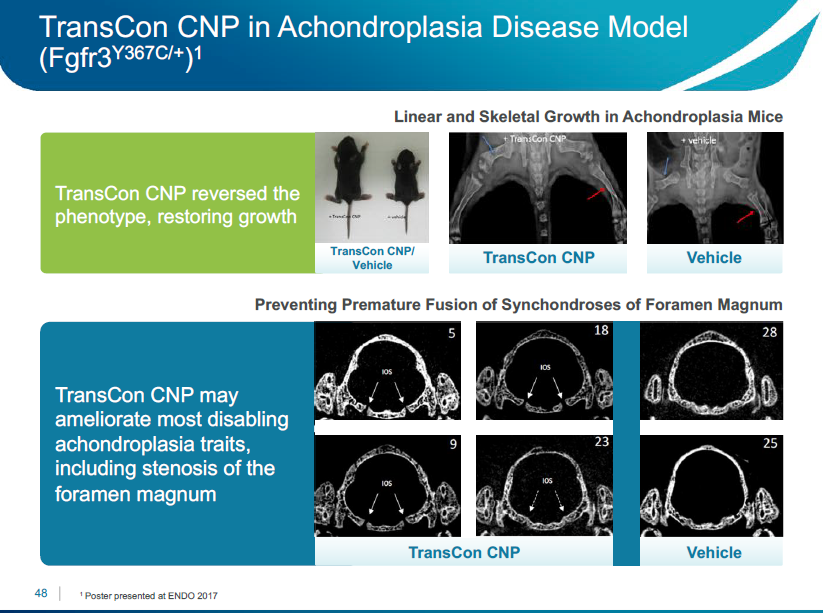
軟骨無形成症モデルにおけるTransCon CNP(Fgfr3Y367C / +)1
TransCon CNPは、大後頭孔の狭窄を含む、最も無力な軟骨無形成症の骨形成を改善する可能性があります。
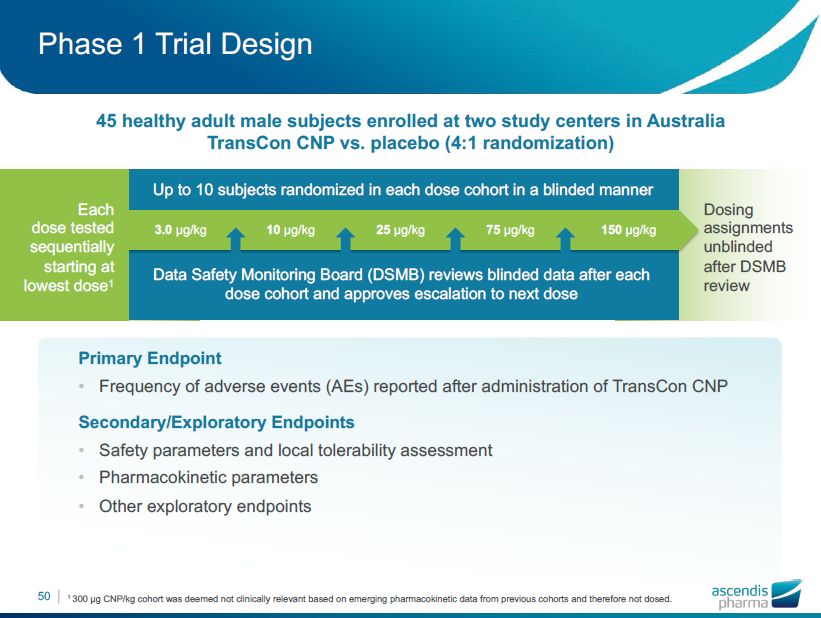
TransCon CNP: 第一相治験

第1相治験のデザイン
- 試験した各用量は順次最低用量で開始しました。
-
盲検法を用い、各用量のコホートにおいて最大10人の被験者を無作為で割り当てました。
データ安全性監視委員会(DSMB)は、各用量のコーホートの投与後、盲検データをレビューし、次の用量へのエスカレーションを承認しました。
- TransCon CNP投与後に報告された有害事象(AE)の頻度
副次的/探索的エンドポイント
- 安全パラメータと地域の耐用性評価
- 薬物動態学的パラメータ
- その他の探索的評価項目
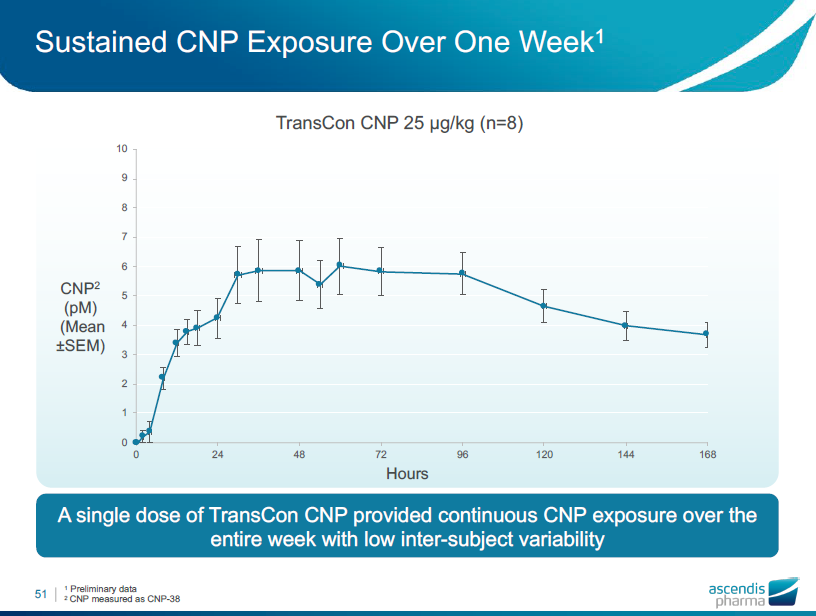
CNPは1週間以上作用を継続
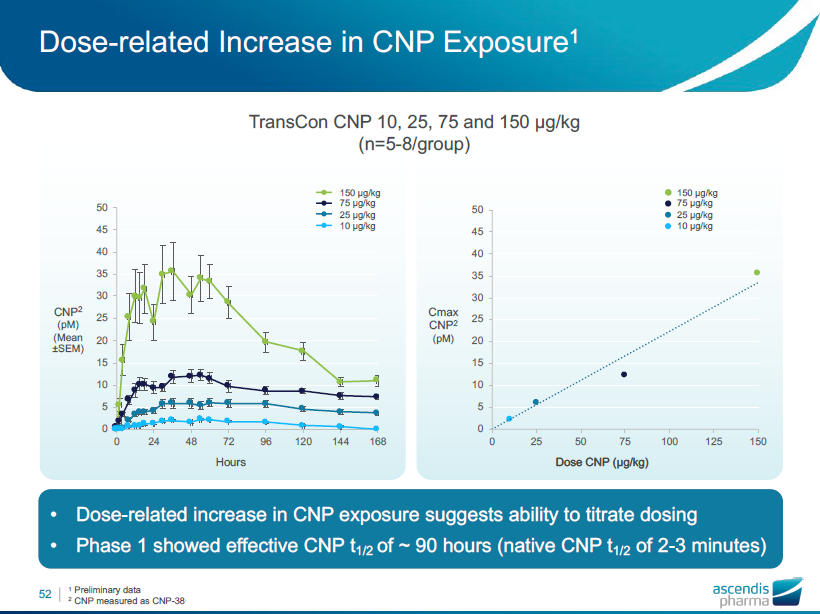
CNPの作用における容量増加
第一相試験では、90時間までのCNP t 1/2の有効性(2〜3分のネイティブCNP t 1/2)を示しました。
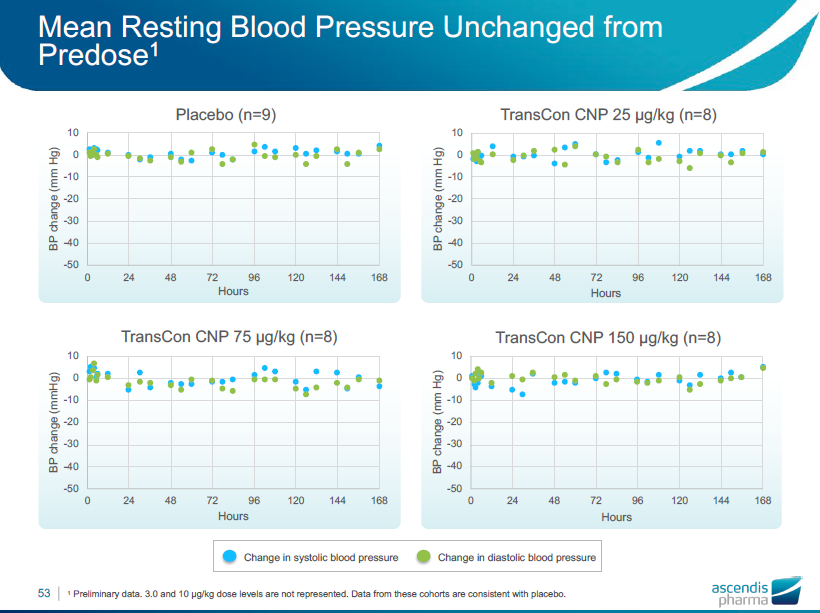
平均安静時心拍数は投与前と比べ変化しない 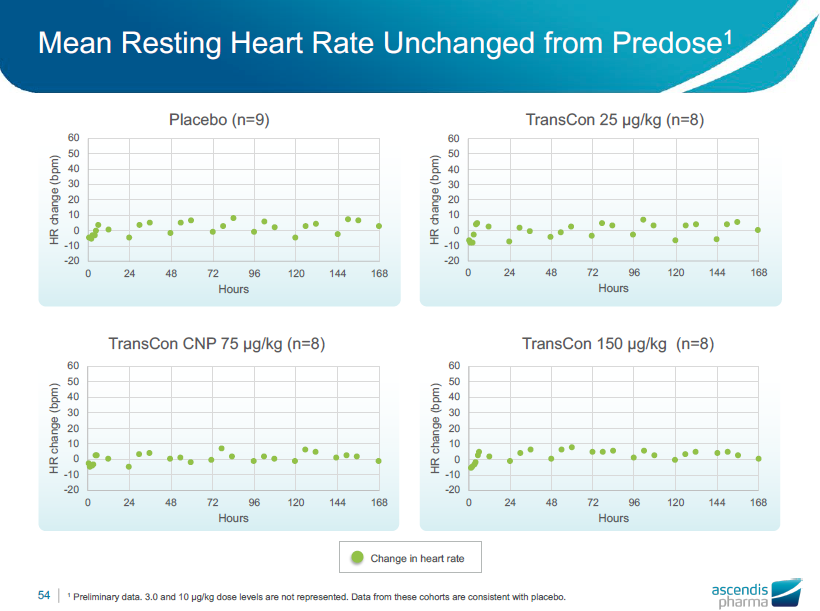
良好な 耐用性を示す安全性プロファイル
•TransCon CNPは、150 µg / kgまでの用量で全般的に耐容性は良好でした。
•平均安静時血圧および心拍数は、すべてのコホートにおいて、すべての時点で投与前と変わりませんでした。
•バイタルサインの平均的な起立性の変化は、TransCon CNPの作用とは無関係と考えられました; プラセボとTransCon CNPコホート間での一貫性がありました。
•投与はすべての用量コホートで良好な耐用性が確認できました。 また、注射によるAEは報告されませんでした。

TransCon CNP第1相データは前臨床試験からのPKプロファイルおよび心血管安全性を再現しました。
-1週間に1回の投与を支持されます。(1回の皮下投与で7日間持続的にCNPが作用したため)
– 目標レベルでCNPの作用が持続することは、CNP / FGFR3経路のバランスの取れた成長を維持するために重要です。
-すべてのコホートで全般的に忍容性が良好でした。
-身長に影響を与えるだけでなく、軟骨無形成症に関連する多くの合併症にも対処することで、患者の生活を劇的に変える可能性があります。
-第二相試験の開始は、2019年第3四半期を想定します。
-複数の特許が2037年まで潜在的に保護できる見込みです。



