BioMarinは2019年11月14日、ニューヨークで行われた同社主催の第7回 R&D Dayにおいて、軟骨無形成症の治療薬として開発中のVosoritideに関し、「フェーズ3の先にある潜在的ブロックバスター(大型医薬品)」と題した発表を行いました。
以下発表資料において日本語の仮訳を掲載します。
BioMarin presented at the 7th R&D Day on November 15, 2019 in New York. The theme regarding Vosoritide was “Our Next Phase 3 readout for potential Blockbuster”
——————————————————————————————————-

フェーズ3の先にある潜在的ブロックバスター(大型医薬品):
軟骨無形成症のためのVosoritide
・グローバル・フェーズ3は、すべての被験者の登録が完了
・トップラインデータ(※)は、2019年末を想定
・0-5歳未満の幼児を対象とした試験は次のとおりに進行中
・コーホート1(月齢:24-60か月)は被験者登録完了
・コーホート2(月齢:6-24か月)は2019年末までに被験者登録が完了見込
・コーホート3(月齢:新生児-6か月)は前監督員の登録完了
※臨床試験の結果が事前に設定された主要評価項目に達成したか否かを評価するためのハイレベル・データ

Vosoritideのプログラムを支える4つの柱
■第3相試験(301、302):成功の鍵は2019年末のトップラインデータ
■自然歴研究:
・年齢や性別に応じた試験データとの比較分析(N>600)
・2020のNDA/MAA締結を目指す
■第2相試験(202、205):4.5歳以上を対象とした継続的な有効性と計測
■第2相試験(206、208):0-5歳の乳幼児を対象

第3相試験(301、302):成功の鍵は2019年末のトップラインデータ
・最後の患者さんの登録を完了(2019年10月30日)
・301試験における被験者登録の総数は121人
・121人中、119人が302(延長試験)に進む(10月31日)
・規制当局への提出/ 著名な学術機関誌への投稿など全てを2020年に計画

第3相試験および第2相試験は同等の分布
第3相試験および第2相試験は同等の分布
・第3相試験のベースラインのパラメーターは第2相試験のものと比較可能
第3相試験および第2相試験は同等の分布
・被験者110名の90%において各々のベースラインから年間の平均成長速度が1.75cm増加(2.8SD)
現在、121名の被験者において低偏差(~2.0 SD)を計測
・被験者95%超において各々のベースラインから年間の平均成長速度が1.75cm増加
・Z-scoreの身長とプロポーションを含むエンドポイントを予め特定可能
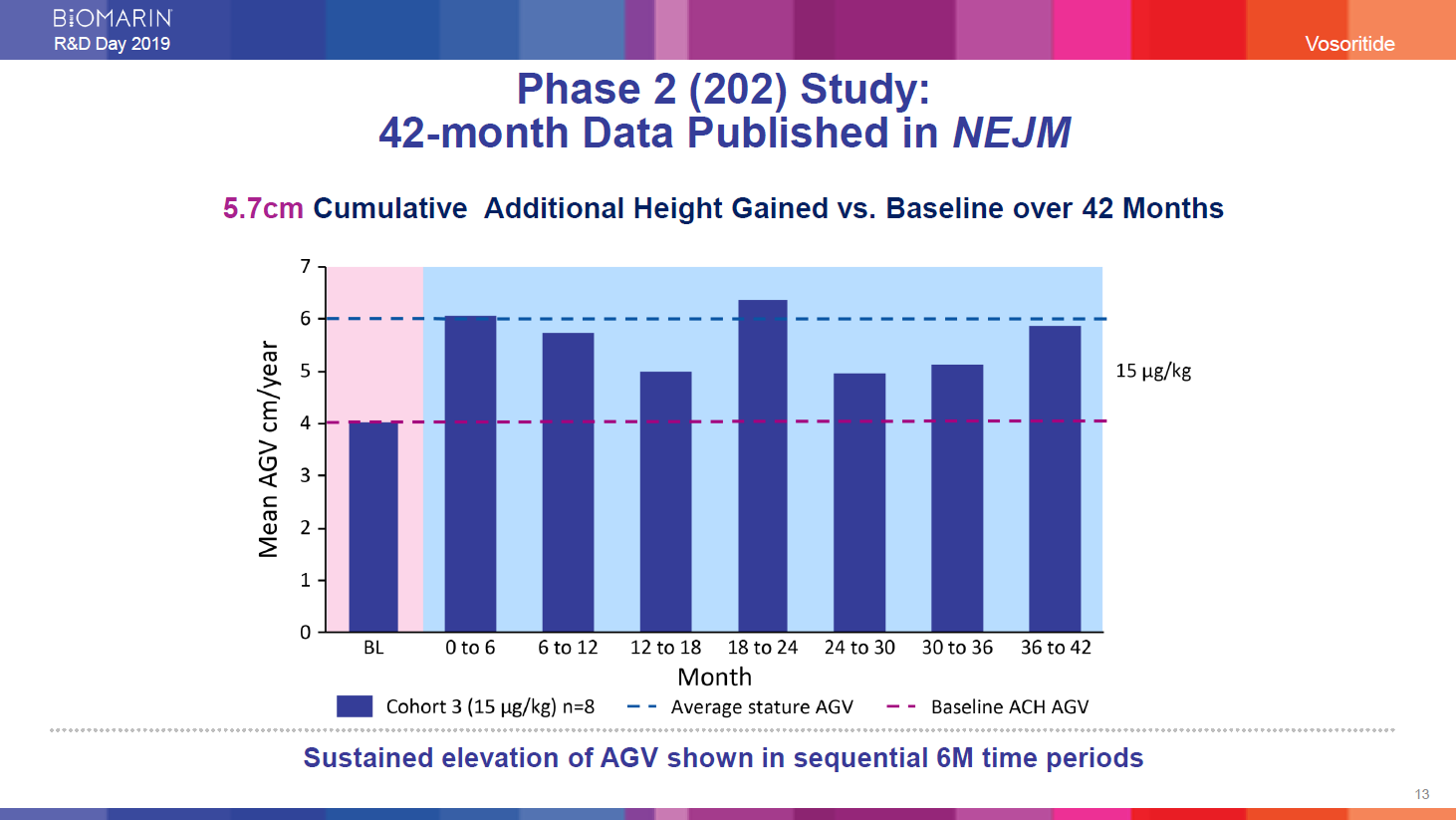
第2相試験(202):42か月間のデータをNEJM※に投稿
※ニューイングランド・ジャーナル・オブ・メディシン
年間平均成長速度は累積5.7 cm 42か月間のベースライン VS 成長速度の増加
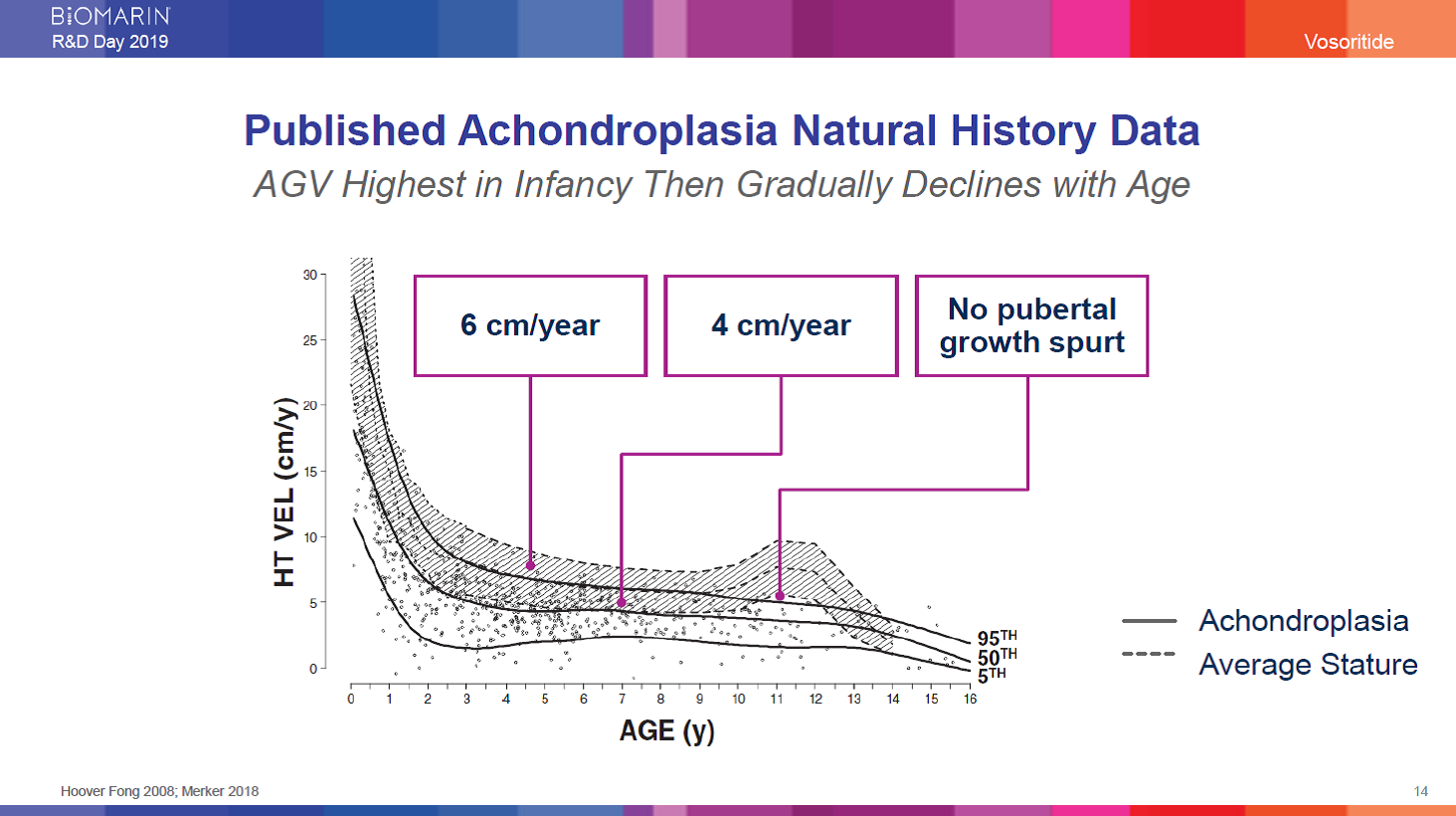
軟骨無形成症の自然歴研究データの投稿
年間平均成長速度は乳児において最も大きく、年齢と共に徐々に低下
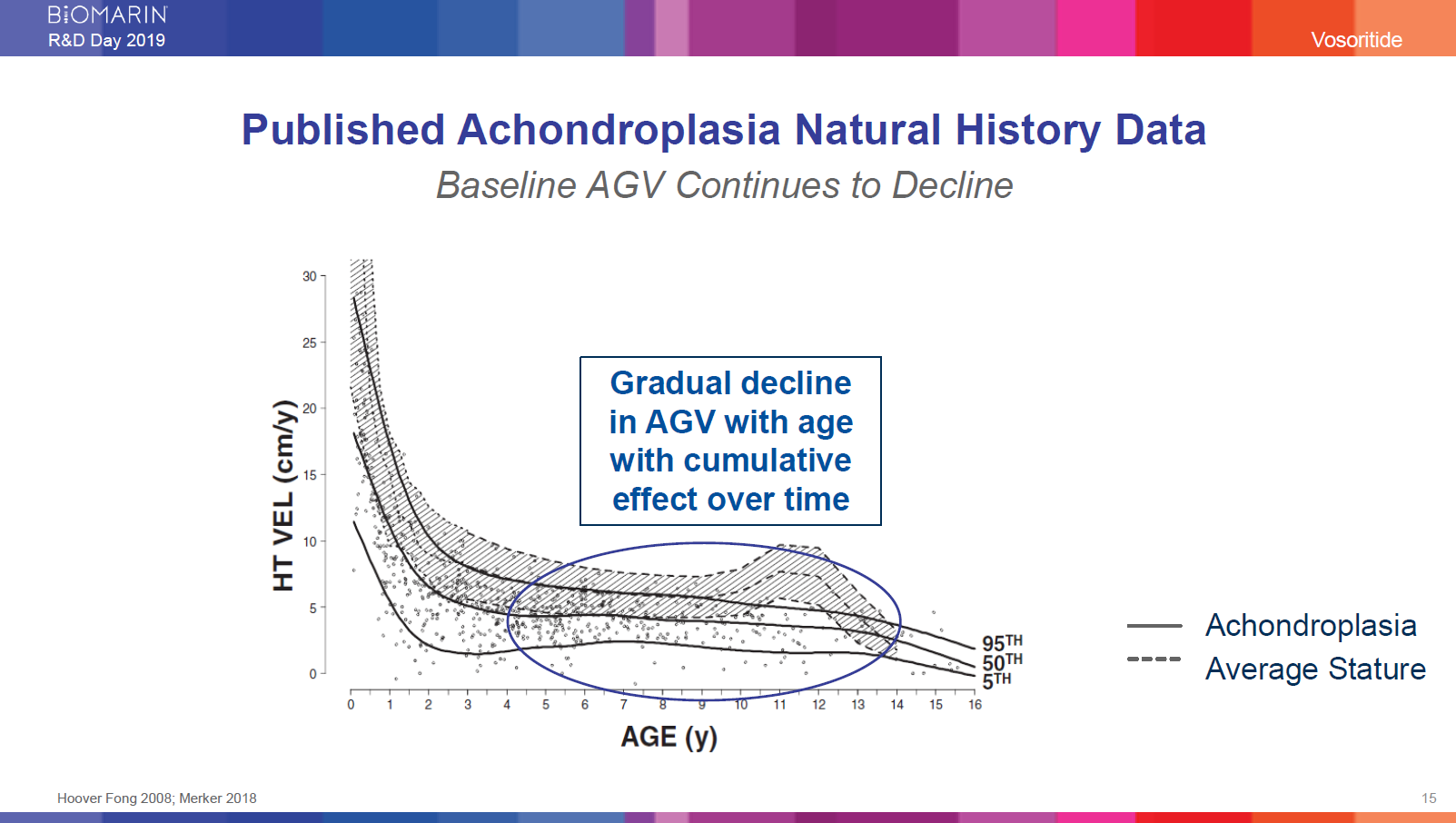
軟骨無形成症の自然歴研究データの投稿
年間平均成長速度のベースラインは低下の一途

自然歴研究データとの同時併行
・米国の4つの著名な骨系統疾患の専門センターとの共同
・著名な複数施設との自然歴研究、被験者数:1,377人
・ジョンズホプキンス大学のDr. Hoover-Fongおよびその他の方々
・比較基準群を満たすようデザイン
・統計分析計画と効果測定を明確に定義したプロトコル
・男女の比較基準および多くの成長データ(13,000以上の計測)
・小児の全年齢層をカバーする患者データ
・次のステップ
・効果のある期間を示す5年間の第2相試験データの比較分析
・2019/2020の承認に向けた10の著名な投稿を計画
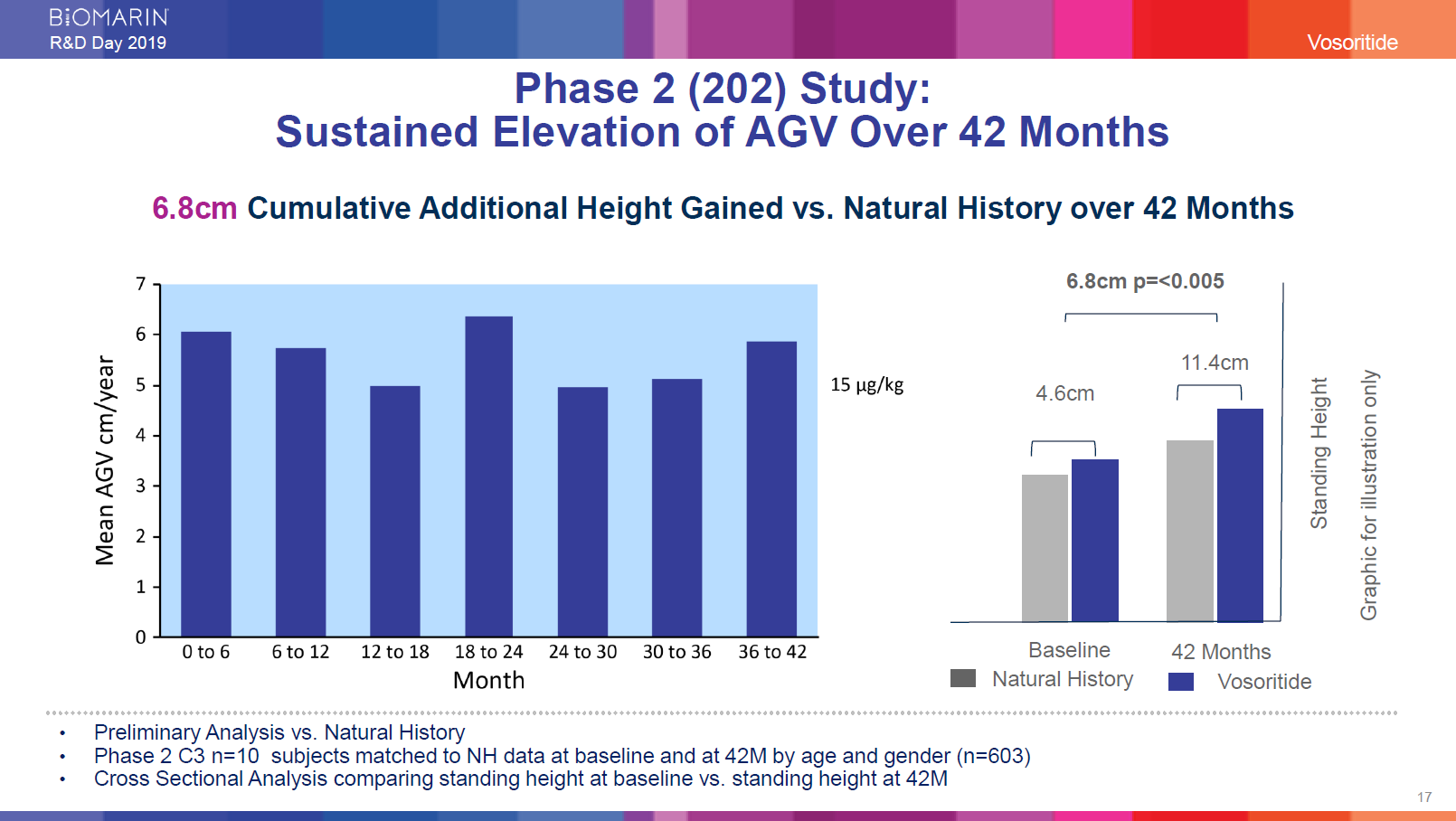
第2相試験(202):
42か月間の平均成長速度の継続的な上昇
年間平均成長速度は累積6.8 cm 42か月間のベースライン VS 成長速度の増加
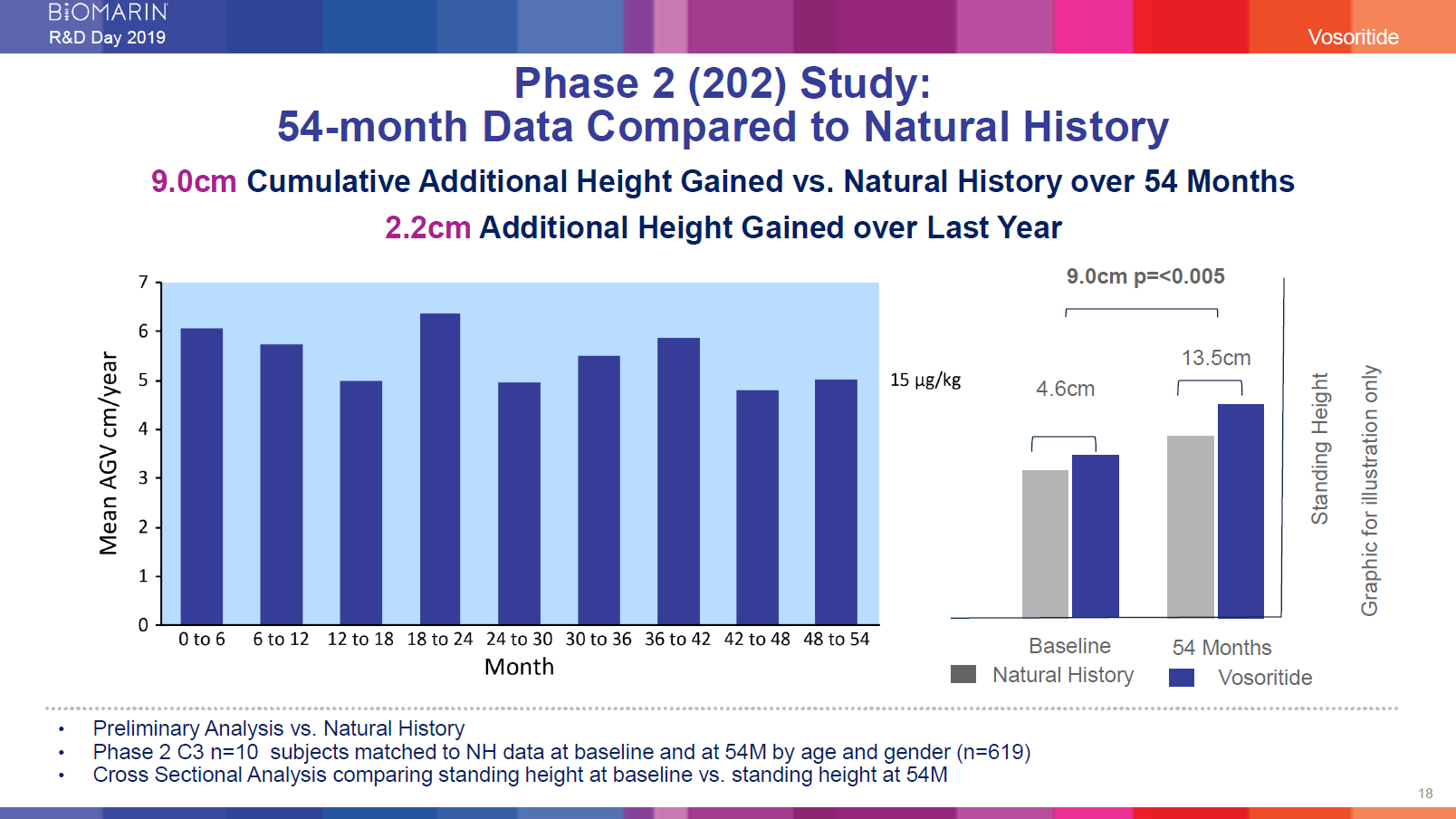
第2相試験(202):
自然歴との54か月のデータ比較
年間平均成長速度は累積9.0 cm 54か月間のベースライン VS 成長速度の増加
直近1年では2.2cmの成長速度の増加

第2相試験(206):0-5歳の乳幼児
・3つのコーホート:C1(2-5歳)は被験者登録完了 / C2(6か月-2年)は2019年末までに登録が完了見込 / C3:(0-6か月)登録開始
・少ない投与で薬の蓄積や過剰投与のリスクを回避
・乳幼児の安全性および忍容性は第2相試験での観測と同じ
・乳幼児の投与に関する日々の忍容性・詳細は12月を想定

第2相試験(206):
乳幼児の安全性プロファイルと第2相試験の最新の安全性
・6か月未満の対象者を含み、全研究および投与において全般的に良い忍容性
・去年は28,000の日次投与を実施し、低血圧症が発生したのは0.0035%
・今では57,000以上の皮下注射を実施したが低血圧症が発生は未だ0.0035%
・更なる評価を推進するためプラセボと比較

開発中のVosoritide ペン
承認以降のフォローを行うために当ペンを開発中
・Palynziqからの教訓を応用
・Vosoritideのライフサイクルをサポート
運用上の特徴
・単回投与毎の使い捨てカートリッジを使用

要約: Vosoritideの54か月もの間持続した成長速度への影響、
多方面のグローバルプログラムの急速な展開
・第3相試験は、年末までにトップライン・データの取得を想定
・NDA/MAAを支援する有力な比較基準(自然歴研究のデータセット)
・4.5歳以上では54か月間効果が持続
・自然歴データと比較して54か月で累積9.0cmの更なる身長増加
・現在、安全なPK値を測定するため乳児に投与中
・心血管疾患は、0.0035%に留まる
次のステップ:国際共同治験として登録を完了した第3相試験のトップラインデータを年末に発表することを計画


