2021年11月19日(現地時間)、BioMarinは開発中の小児の軟骨無形成症の治療薬vosoritideについて、以下のプレスリリースを発表しました。本資料は、GTAが当該プレスリリースのメインパートを日本語に翻訳し、配信するものです。
※本資料の正式言語は英語であり、その内容および解釈については正式言語が優先します。詳細はSourceをご参照ください。
On November 19, 2021 (local time), BioMarin announced the following press release regarding vosoritide, a drug for the treatment of children with achondroplasia that is under development. GTA translated the main part on this press release into Japanese and distributes it.
* The official language of this document is English, and this language has priority over its content and interpretation. See Source for details.
————————————————————————-
BioMarin、注射剤VOXZOGO™(ボソリチド)のFDA承認を取得、5歳以上の軟骨無形成症の小児の線形成長の増加を示す
不均衡な低身長の代表形態である軟骨無形成症の最初の治療法
11月19日(金)11時30分~(東部時間)において投資家との電話会議・ウェビナーを実施
2021年11月19日
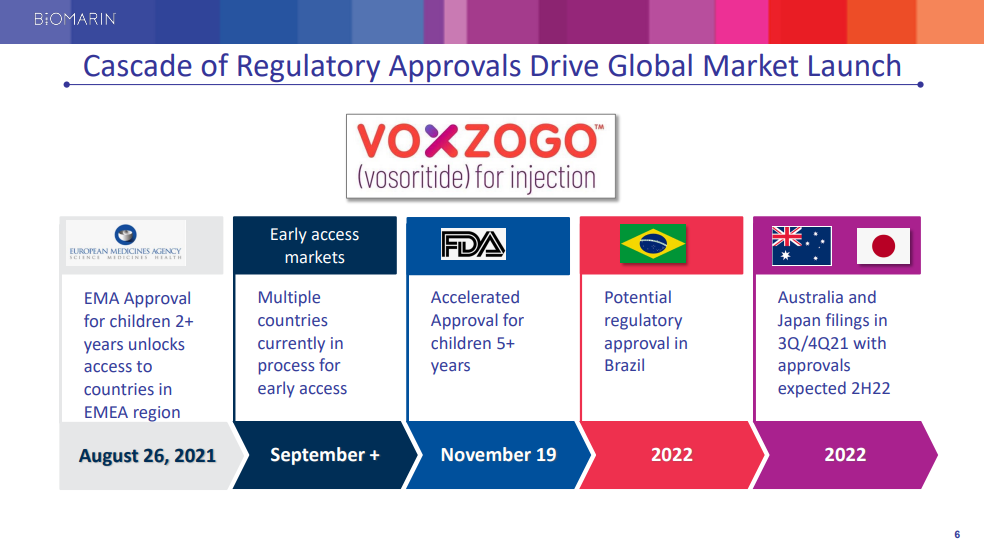
カリフォルニア州サンラファエル、2021年11月19日/ PRNewswire / -BioMarin Pharmaceutical Inc.(NASDAQ:BMRN)は本日、米国食品医薬品局(FDA)が迅速承認制度において注射剤VOXZOGO™(ボソリチド)を承認したことを発表しました。 5歳以上の軟骨無形成症の骨端板(成長板)が開いている小児患者において、線形成長を増加させることが示されました。 この適応症は、年間成長速度(AGV)の改善に基づく迅速承認制度において承認されました。 この適応症の継続的な承認は、確認研究における臨床的利益の検証と説明を条件とする場合があります。 この市販後の要件を満たすために、BioMarinは、利用可能な自然歴研究と比較して、進行中の非盲検延長試験を使用する予定です。
Voxzogoは、軟骨無形成症の小児への最初のFDA承認治療薬です。 軟骨無形成症の患者では、骨組織が形成される重要なプロセスである軟骨内骨成長において、線維芽細胞成長因子受容体3遺伝子(FGFR3)の機能変異が起こることで悪影響が生じます。C型ナトリウム利尿ペプチド(CNP)アナログであるVoxzogoは、軟骨内骨の成長を促進するためにFGFR3の下流のシグナル伝達経路の良好な調節因子として機能するニュー・クラスの治療薬となります。
BioMarinの会長兼CEOのJean-Jacques Bienaiméは次のように述べています。「Voxzogoは、分子遺伝学におけるBioMarinのフォーカス領域をルーツとし、遺伝的状態の根本的な原因を対象とする最初の治療薬です。10年以上のサイエンス研究によって、Voxzogoが示す医学的進歩が支えられています。 私たちは、軟骨無形成症の小児のための最初治療の選択肢としてその価値を認識してくれたFDAに感謝いたします」、「私たちは、ボソリチドの可能性を最大限に追究し続け、この包括的な臨床研究プログラムに参加し続けているコミュニティ、臨床研究者、そして子どもたちとその家族に感謝の意を表します。」
Voxzogoの臨床試験の研究者であり、Lundquist Instituteの研究者Harbor-UCLAの David Geffen School of Medicine の准教授Lynda Polgreenは言います。「軟骨無形成症は、小児期の軟骨内骨成長障害によって生じる骨格構造の乱れに起因する、生涯にわたる遺伝的状態です」、「この承認は、5歳以上の軟骨無形成症の子供たちをもつ家族のために、医師が病状の根本原因を対象とする治療を初めて提供できるようになる重要なマイルストーンです。」
小人症の人々の医療の質的向上に関する研究支援を使命とする組織、Growing Strongerの共同創設者であるAmer Haiderは、次のように述べています。「当進行性の遺伝的状態に対する緊急のアンメット・メディカルニーズを理解したFDAを称賛します。軟骨無形成症の小児を持つ親として、骨の成長に影響を与える治療法の利用可能性が重要な前進であると考えています」。当組織は、小人症に焦点を当てた研究者に充てる非営利の寄付を募っています。
Haider氏は、「BioMarinは軟骨無形成症コミュニティを引き続きサポートしており、希少な遺伝的状態での標準治療を進歩させてきた長い実績があります」と付け加えました。
この承認を受けて、FDAは希少な小児疾患優先審査バウチャー(PRV)も発行しました。これは、他の方法では優先審査の対象とならない後続の薬剤申請に優先審査を付与するものです。 PRVプログラムは、希少な小児疾患の予防または治療のための新薬および生物製剤の開発を促進するように設計されています。
Voxzogoは、12月中旬から下旬までに米国で発売開始される予定であり、BioMarinはすぐにVoxzogoのプロモーションを開始します。
承認は、Voxzogoの有効性と安全性を評価する国際無作為二重盲検プラセボ対照第3相試験の結果と、この第3相試験の非盲検延長に基づいていました。この研究では、軟骨無形成症の5〜14.9歳の121人の小児が登録されました。プラセボ群とVoxzogo群のベースライン平均AGVは、それぞれ4.06cm /年と4.26cm /年でした。 52週目で、AGVのベースラインからの変化はプラセボ治療患者で-0.17 cm /年、Voxzogo治療患者で1.40 cm /年であり、Voxzogoに有効な1.57 cm /年のAGVの統計的有意な改善をもたらしました。 52週間の二重盲検、プラセボ対照、第3相試験の後、最初にVoxzogoに無作為抽出された58人の被験者が非盲検延長に登録されました。無作為化から2年間の追跡調査を受けた被験者では、AGVの改善が維持されました。
2021年8月、欧州委員会(EC)はVoxzogoを承認しました。日本、ブラジル、オーストラリアでは販売承認審査が進行中であり、2022年にこれらの国で承認される可能性があります。


———————————–
BioMarin Receives FDA Approval for VOXZOGO™ (vosoritide) for Injection, Indicated to Increase Linear Growth in Children with Achondroplasia Aged 5 and Up with Open Growth Plates
1st Therapeutic Treatment for Achondroplasia, Most Common Form of
Disproportionate Short Stature
Investor Conference Call and Webinar to be Held on Friday, Nov. 19 at 11:30 AM Eastern
Nov 19, 2021
SAN RAFAEL, Calif., Nov. 19, 2021 /PRNewswire/ — BioMarin Pharmaceutical Inc. (NASDAQ: BMRN) today announced that the U.S. Food and Drug Administration (FDA) has granted accelerated approval to VOXZOGO™ (vosoritide) for Injection, indicated to increase linear growth in pediatric patients with achondroplasia five years of age and older with open epiphyses (growth plates). This indication is approved under accelerated approval based on an improvement in annualized growth velocity (AGV). Continued approval for this indication may be contingent upon verification and description of clinical benefit in confirmatory studies. To fulfill this post-marketing requirement, BioMarin intends to use the ongoing open-label extension studies compared to available natural history.
Voxzogo is the first FDA approved treatment for children with achondroplasia. In patients with achondroplasia, endochondral bone growth, an essential process by which bone tissue is created, is negatively regulated due to a gain of function mutation in fibroblast growth factor receptor 3 gene (FGFR3). Voxzogo, a C-type natriuretic peptide (CNP) analog, represents a new class of therapy, which acts as a positive regulator of the signaling pathway downstream of FGFR3 to promote endochondral bone growth.
“Voxzogo is a medical first that is rooted in BioMarin’s focus on molecular genetics and targets the underlying cause of the condition. More than a decade of scientific research underpins the medical advance that Voxzogo represents. We thank the FDA for recognizing its value as the first therapeutic treatment option for children with achondroplasia,” said Jean-Jacques Bienaimé, Chairman and Chief Executive Officer of BioMarin. “We extend our gratitude to the community, clinical investigators and the children and their families, who participated and continue to participate in our comprehensive clinical research program as we continue to investigate the full potential of vosoritide.”
“Achondroplasia is a lifelong genetic condition resulting from the disordered skeletal architecture caused by impaired endochondral bone growth throughout childhood,” said Lynda Polgreen, M.D., an investigator in clinical trials for Voxzogo and an Investigator at The Lundquist Institute at Harbor-UCLA Associate Professor at David Geffen School of Medicine – UCLA. “This approval is an important milestone representing the first time that physicians will be able to offer a therapy targeted at the root cause of the condition for families of children with achondroplasia aged five and older.”
“We applaud the FDA for recognizing the urgent unmet medical need for this progressive condition. As a parent of a child with achondroplasia, I see the availability of treatments that impact bone growth as an important step forward,” said Amer Haider Co-Founder of Growing Stronger, an organization with a mission to improve the quality of medical care for little people through supporting research. The organization raises nonprofit donations that are granted to researchers focused on dwarfism.
Mr. Haider added, “BioMarin continues to support the achondroplasia community and has a long track record of advancing the standard of care in rare genetic conditions.”
With this approval, the FDA also issued a Rare Pediatric Disease Priority Review Voucher (PRV), which confers priority review to a subsequent drug application that would not otherwise qualify for priority review. The rare pediatric disease PRV program is designed to encourage development of new drugs and biologics for the prevention or treatment of rare pediatric diseases.
Voxzogo is expected to be available in the United States by mid- to late-December, and BioMarin will begin the promotion of Voxzogo immediately.
The approval was based on the outcomes of a global randomized, double-blind, placebo-controlled Phase 3 study evaluating the efficacy and safety of Voxzogo and the open-label extension of this Phase 3 study. The study enrolled 121 children aged 5 to 14.9 with achondroplasia. Baseline mean AGV in the placebo and Voxzogo groups was 4.06 cm/year and 4.26 cm/year, respectively. At week 52, the change from baseline in AGV was -0.17 cm/year for the placebo treated patients and 1.40 cm/year for the Voxzogo treated patients, resulting in a statistically significant improvement in AGV of 1.57 cm/year in favor of Voxzogo. After the 52 week double blind, placebo–controlled, phase 3 study, 58 subjects initially randomized to Voxzogo enrolled into an open–label extension. Among the subjects who had two years of follow–up since randomization, the improvement in AGV was maintained.
In August 2021, the European Commission (EC) approved Voxzogo. Marketing authorization reviews are in process in Japan, Brazil, and Australia with potential approvals in these countries in 2022.
Source: BioMarin’s website



はじめまして。
いよいよ明日、厚生労働省で審議されますね。
無事に承認されることを願っています。
ありがとうございます。知る人ぞ知る大きなマイルストーンですね。ほんと祈るばかりです!
無事に承認される見込みとなり、ひと安心です。
業界メディアが報じてますね。後はその時を待つのみです!