BioMarinは2019年9月10日にニューヨークで行われたた第17回モルガンスタンレー・グローバル・ヘルス・カンファレンスにおいて、軟骨無形成症の治療薬として開発中のVosoritideに関し、「フェーズ3の先にある潜在的ブロックバスター(大型医薬品)」と題した発表を行いました。次のような内容が含まれています。
- フェーズ3のデータに関するタイムライン
- フェーズ2(新生児・幼児向け)における年齢別投与群のタイムライン
- フェーズ2(5歳以上)の42か月の年間成長速度データ
以下発表資料において日本語版の仮訳を掲載します。
BioMarin presented at the Morgan Stanley 17th Annual Global Healthcare Conference on September 10, 2019 at 8:35am ET in New York. The thema regarding Vosoritide was “Our Next Phase 3 readout for potential Blockbuster” and including following contents.
– Timeline on Phase 3 data
– Timeline on Phase 2 for each cohort of infants and toddlers
– Sustained growth data of Phase 2 for children age 5 and above
——————————————————————————————————-

フェーズ3の先にある潜在的ブロックバスター(大型医薬品)
・被験者登録完了済のグローバル・フェーズ3は、2019年末にデータがまとまる見込み
・0-5歳未満の幼児向けは次のとおりに進行中
・コーホート1(月齢:24-60か月)は被験者登録完了。
・コーホート2(月齢:6-24か月)は2019年末にまでに被験者登録が完了見込。
・コーホート3(月齢:新生児-6か月)は2019年末までに被験者登録を開始。

Vosoritide- 軟骨無形成症の治療薬市場初の上市の可能性に向けて
Vosoritideとは何か?
・Vosoritideは特定の受容体に結合し、過活動するFGFR3を抑えるべく細胞内信号として機能します。FGFR3の過活動を抑制することで、小人症の最も一般的な疾患である軟骨無形成症の軟骨と骨の成長を促します。
なぜVosoritideが重要か
・骨延長術を除き、承認された(尚且つ確実な)治療法は存在しません。
・下記のような深刻な合併症が発生します:
・大後頭孔狭窄 ・腰の永続的な弯曲
・睡眠時無呼吸症候群 ・腰部脊柱管狭窄症
・O脚 ・肥満
Vosoritide- 軟骨無形成症の治療薬市場初の上市の可能性に向けて
✓投与後最大42か月迄の間、成長速度は継続的に増加
✓良好な忍容性・安全性のプロファイル
✓被験者登録が完了済のグローバル・フェーズ3は、2019年末にデータがまとまる見込み
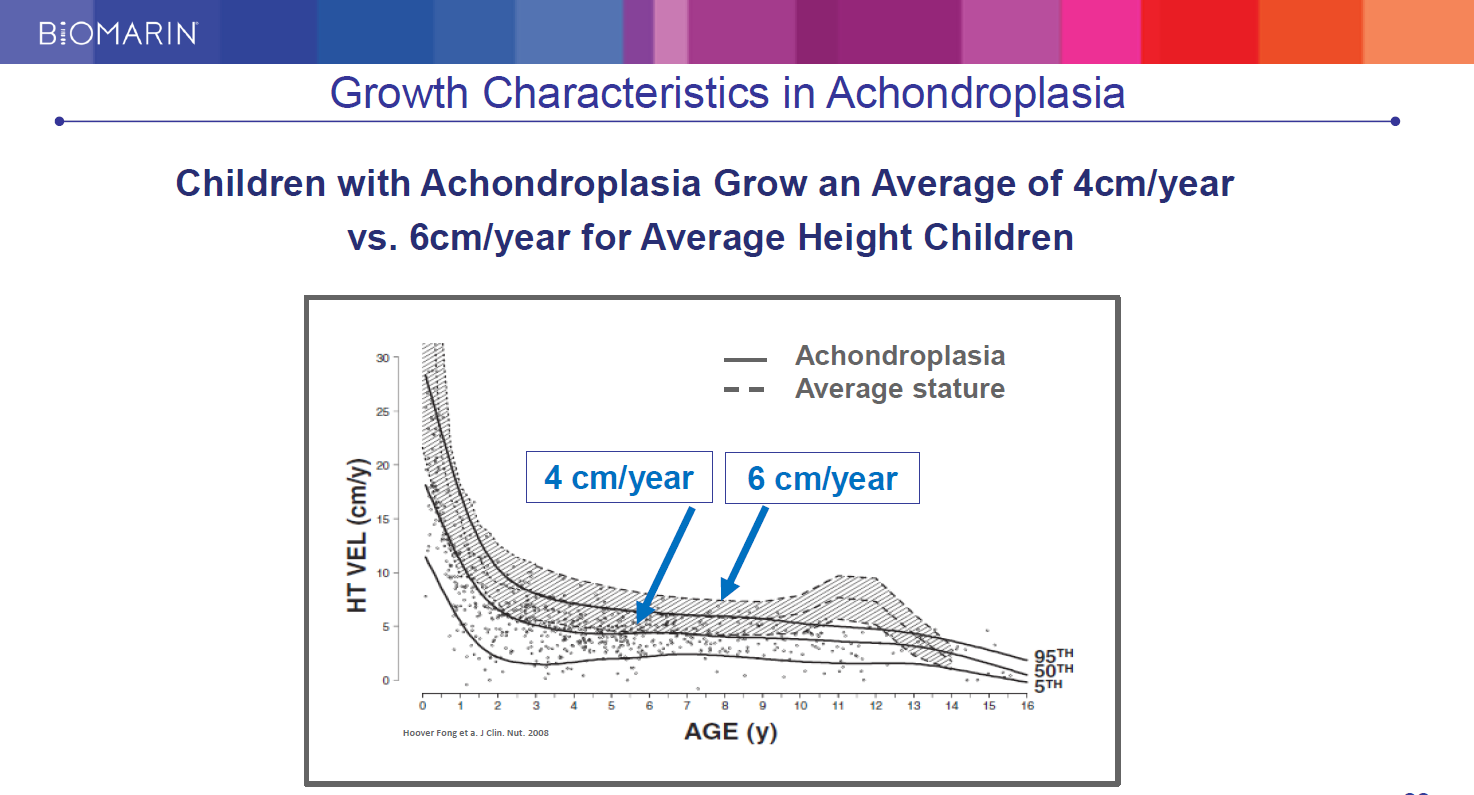
軟骨無形成症の成長曲線
軟骨無形成症の小児の身長の伸びは、年4cmに対して一般の健常児は年6cm。
(凡例)
― 軟骨無形成症
— 健常児
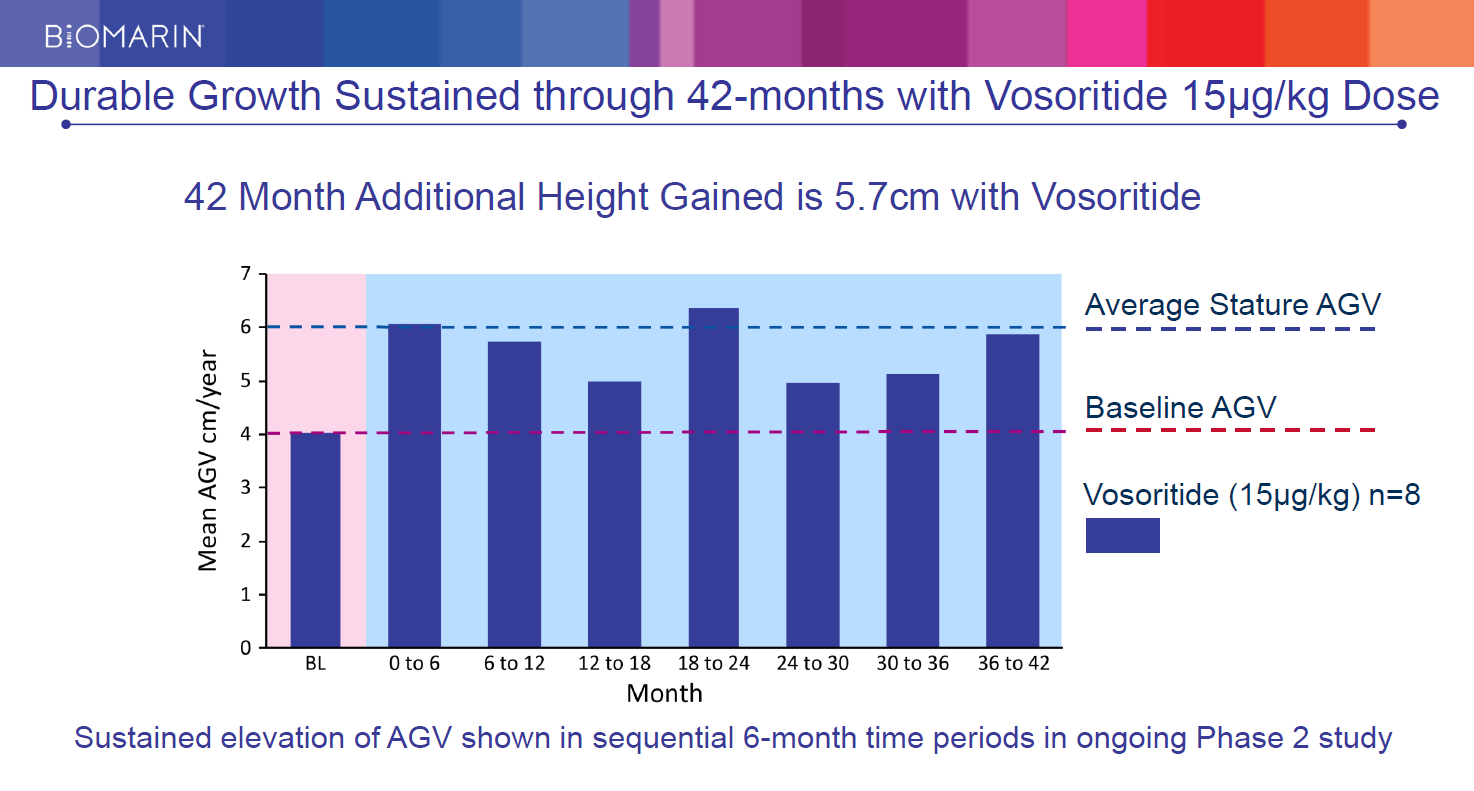
Vosoritide 15μg/ kgの用量で42か月間 持続的な成長
・Vosoritideの投与下では42か月間、年間平均成長速度は5.7 cmとなりました。
出所:継続するフェーズ2における持続的な成長(6か月刻みの年間平均成長速度)
(凡例)
—健常児の年間成長速度
—軟骨無形症のベースライン
■ Vosoritide投与群(15μg/kg)被験者8名

Vosoritideの臨床結果を実証する戦略の実行
Phase 3について
・1年間のプラセボ対照、121の被験者、52週間実施した観察研究および治療
(※:原文の”2year”は誤記(同社確認済み))
・治療群とプラセボ群の統計的有意差の検出率90%
・データ終了2019 / 開始2020
Phase 2(5-14歳)
・42か月目以降の平均5.7cmの身長の伸びについての経過観察
・ほぼ低血圧症の徴候なく忍容性は良好。30,000回以上の投与を管理する中で、症候性低血圧が報告されたのは1件のみ
・2019年末で54か月のデータが揃う
Phase 2(0-5歳未満)
・コーホート1(月齢:24-60か月)は被験者登録完了
・コーホート2(月齢:6-24か月)は2019年末にまでに被験者登録が完了見込
・コーホート3(月齢:新生児-6か月)は2019年末までに被験者登録を開始
・安全性データは、当局承認時に利用可能となる見込み
自然歴研究のデータ
・多施設、既往/将来、診療課横断的な研究
・効率性評価を裏付ける自然歴データと治療を経た成人の最終身長との比較


